Marta Cyman
Gdański Uniwersytet Medyczny
strony wersji drukowanej: 42-48

Oznaczanie rodzaju i stężenia białek w materiale biologicznym jest jednym z najbardziej podstawowych oznaczeń wykonywanych w laboratoriach medycznych i naukowych. Efektywne badania białek są istotne nie tylko w przypadku materiału klinicznego pochodzącego od pacjentów ale także w pracach naukowych. Właśnie w ramach prac badawczych są opracowywane, udoskonalane i zatwierdzane nowoczesne metody oznaczania białek. Postęp technologii i „głód“ wiedzy wymaga stosowania bardziej wysublimowanych technik niż podstawowe metody kolorymetryczne i strąceniowe. Niniejszy artykuł ma na celu przegląd kilku najbardziej znanych współczesnych metod identyfikacji białek i pomiaru ich stężenia. Obecnie w diagnostyce medycznej część tych metod jest stosowana rutynowo, jednak nie na masową skalę i nie we wszystkich ośrodkach leczniczych.
strony wersji drukowanej: 42-48

Oznaczanie rodzaju i stężenia białek w materiale biologicznym jest jednym z najbardziej podstawowych oznaczeń wykonywanych w laboratoriach medycznych i naukowych. Efektywne badania białek są istotne nie tylko w przypadku materiału klinicznego pochodzącego od pacjentów ale także w pracach naukowych. Właśnie w ramach prac badawczych są opracowywane, udoskonalane i zatwierdzane nowoczesne metody oznaczania białek. Postęp technologii i „głód“ wiedzy wymaga stosowania bardziej wysublimowanych technik niż podstawowe metody kolorymetryczne i strąceniowe. Niniejszy artykuł ma na celu przegląd kilku najbardziej znanych współczesnych metod identyfikacji białek i pomiaru ich stężenia. Obecnie w diagnostyce medycznej część tych metod jest stosowana rutynowo, jednak nie na masową skalę i nie we wszystkich ośrodkach leczniczych.
 W organizmie ludzkim białka odpowiedzialne są zarówno za podstawowe funkcje życiowe jak i za przeprowadzanie złożonych reakcji. W samym osoczu ludzkim występuje ponad 700 rodzajów białek. Powstające na matrycy mRNA białka są ostatecznym produktem ekspresji genów, czyli wyrazem aktywności danej sekwencji genomu. Jednak nie zawsze można postawić znak równości pomiędzy ilością mRNA i ilością powstającego w procesie translacji białka. Spowodowane jest to występowaniem etapu obróbki potranslacyjnej, podczas którego dochodzi do modyfikacji właściwości chemicznych i fizycznych białka, jego aktywności i stabilności oraz w konsekwencji także pełnionej funkcji. Może to prowadzić do powstawania kilku rodzajów białek z tej samej matrycy DNA. Analiza ludzkiego genomu dostarcza informacji jedynie o rodzaju kodowanych białek. Wciąż nieznane są wszystkie modyfikacje jakim one ulegają, ich funkcje oraz oddziaływania między nimi i w konsekwencji mechanizmy działania komórek, tkanek, organów, układów i całego organizmu człowieka. Nauka zajmująca się białkami w kontekście stworzenia proteogramu to proteomika. Rozwój tej dziedziny był możliwy dzięki dostępności szeregu metod analizy białek, których część zostanie krótko omówiona w niniejszym artykule.
W organizmie ludzkim białka odpowiedzialne są zarówno za podstawowe funkcje życiowe jak i za przeprowadzanie złożonych reakcji. W samym osoczu ludzkim występuje ponad 700 rodzajów białek. Powstające na matrycy mRNA białka są ostatecznym produktem ekspresji genów, czyli wyrazem aktywności danej sekwencji genomu. Jednak nie zawsze można postawić znak równości pomiędzy ilością mRNA i ilością powstającego w procesie translacji białka. Spowodowane jest to występowaniem etapu obróbki potranslacyjnej, podczas którego dochodzi do modyfikacji właściwości chemicznych i fizycznych białka, jego aktywności i stabilności oraz w konsekwencji także pełnionej funkcji. Może to prowadzić do powstawania kilku rodzajów białek z tej samej matrycy DNA. Analiza ludzkiego genomu dostarcza informacji jedynie o rodzaju kodowanych białek. Wciąż nieznane są wszystkie modyfikacje jakim one ulegają, ich funkcje oraz oddziaływania między nimi i w konsekwencji mechanizmy działania komórek, tkanek, organów, układów i całego organizmu człowieka. Nauka zajmująca się białkami w kontekście stworzenia proteogramu to proteomika. Rozwój tej dziedziny był możliwy dzięki dostępności szeregu metod analizy białek, których część zostanie krótko omówiona w niniejszym artykule.Western blot

Metoda Western blot jest techniką biologii molekularnej umożliwiającą wykrycie konkretnych białek w materiale, który stanowi homogenat tkankowy lub ekstrakt białkowy. Mechanizm działania tego testu opiera się na reakcji antygen-przeciwciało. Pierwszym etapem jest rozdział elektroforetyczny w żelu poliakrylamidowym z dodatkiem SDS (siarczanu dodecylu sodu) – metodą SDS-PAGE (ang. sodium dodecyle sulfate polyacrylamide gel electrophoresis). SDS umożliwia rozdział białek ze względu na ich masę cząsteczkową, co odpowiada długości łańcucha polipeptydowego. Dodatek SDS eliminuje efekt rozdziału pod względem kształtu, powoduje on denaturację białek oraz rozbija wiązania niekowalencyjne, co prowadzi do dysocjacji poszczególnych podjednostek. Podczas elektroforezy SDS-PAGE białka o mniejszej masie cząsteczkowej migrują szybciej niż te o większej masie cząsteczkowej. Rozdział prowadzony jest w żelu składającym się z dwóch części – żelu rozdzielającego (znajdującego się na dole) oraz żelu zagęszczającego (położonego na górze), różnią się one gęstością i wartością pH. Białka o niskiej masie cząsteczkowej zawieszone w buforze o niskim przewodnictwie ulegają skondensowaniu na granicy z żelem zagęszczającym. Koncentracja wynika z obustronnego kontaktu z buforami o wysokim przewodnictwie (buforu elektrodowego i buforu w żelu zagęszczającym). Dzięki takiemu umiejscowieniu możliwy jest efektywny rozdział w części rozdzielającej żelu. Kolejnym etapem jest transfer rozdzielonych białek na membranę nitrocelulozową lub PVDF (polifluorek winylidenu). Istnieje kilka dróg przenoszenia produktów rozdziału – transfer kapilarny, próżniowy lub, najczęściej stosowany, elektrotransfer. W tej metodzie wykorzystuje się fakt, że ujemnie naładowane białka migrują w stronę anody, a umieszczając pomiędzy żelem a anodą wspomnianą membranę, dochodzi do zatrzymania na niej produktów elektroforezy. Tak zwaną „kanapkę transferową“ można przygotować na dwa sposoby. Pierwszy z nich nosi nazwę „mokrego“, ponieważ cały układ zanurzony jest w buforze. Drugi, „półmokry“, zakłada umieszczenie „kanapki transferowej“ pomiędzy nasączonymi buforem bibułkami. Ponieważ detekcja białek wiąże się z wykorzystaniem odpowiednich specyficznych przeciwciał należy na wstępie zablokować miejsca niespecyficznego wiązania na membranie. Blokowanie przeprowadza się poprzez zanurzenie membrany w roztworze innego białka np. żelatyny, albuminy surowicy krwi bydlęcej lub mleka w proszku z dodatkiem detergentu (np. Tween20). W znakowaniu rozdzielonych białek można zastosować dwie metody – bezpośrednią i pośrednią. Metoda bezpośrednia zakłada stosowanie przeciwciał sprzężonych z barwnikiem lub enzymem skierowanych przeciwko poszukiwanym białkom. Metoda pośrednia wiąże się z dwuetapową procedurą. W pierwszym etapie dodaje się przeciwciała przeciwko poszukiwanym białkom (przeciwciała I-rzędowe). W kolejnym etapie dodaje się przeciwciała II-rzędowe skierowanie przeciwko przeciwciałom I-rzędowym, dodatkowo znakowane barwnikiem lub enzymem. Stosowanie enzymu (np. peroksydazy chrzanowej lub fosfatazy alkalicznej) wymaga jeszcze jednego etapu – dodanie do mieszaniny substratu dla enzymu, i w rezultacie reakcji barwnej. Produkt reakcji przedstawia się w postaci prążków. Z uwagi na stosowanie przeciwciał do znakowania produktów reakcji, metodę Western blot nazywa się często Immunoblottingiem. Metoda Western blot znalazła szerokie zastosowanie w diagnostyce medycznej. Rutynowo stosowana jest w diagnostyce zakażenia boreliozą i gruźlicą, a także zakażeń wirusowych, takich jak HIV, koronawirus czy HSV. Znajduje zastosowanie w niektórych chorobach pasożytniczych (wągrzyca) i genetycznych (niedokrwistość Fanconiego).
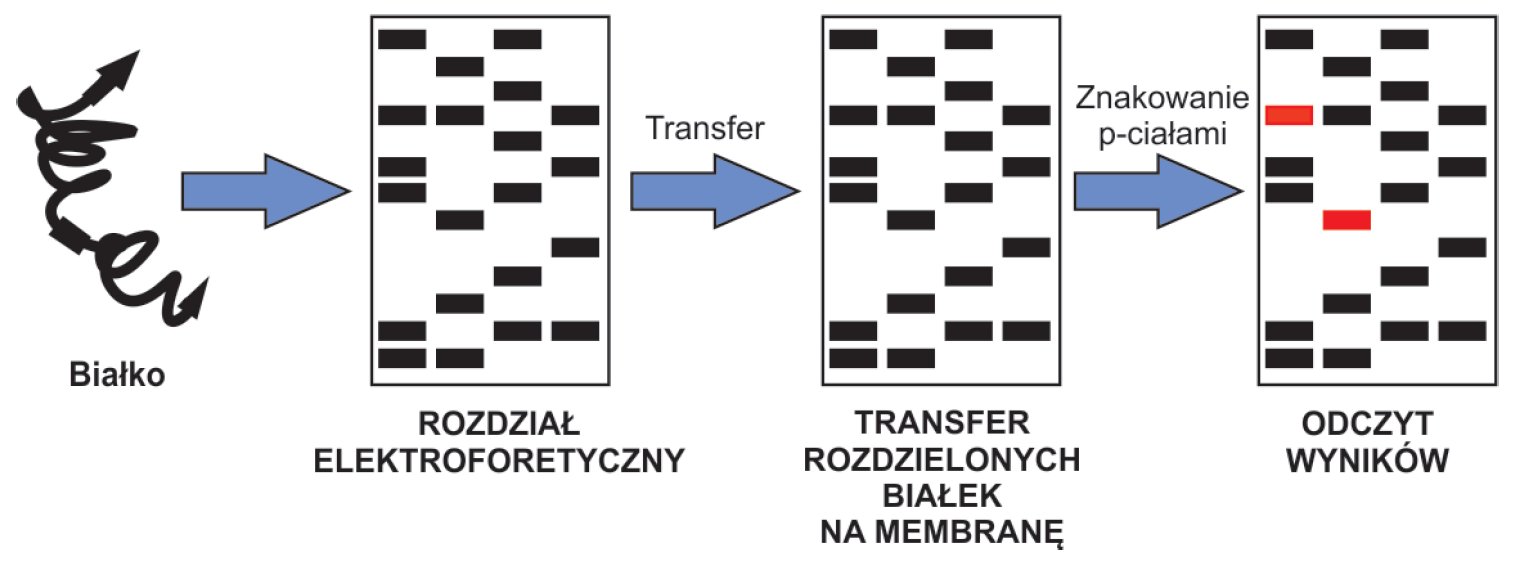
Rycina A. Zasada metody Western blot.
Test ELISA
ELISA (ang. enzyme-linked immunosorbent assay) jest jedną z najczęściej wykorzystywanych metod w badaniach diagnostycznych i naukowych. Podstawowym założeniem tego testu jest reakcja antygen-przeciwciało zachodząca w studzience płytki 96-dołkowej. Istnieje kilka modyfikacji testu ELISA. W celu wykrycia konkretnego białka stosuje się płytki opłaszczone uprzednio przeciwciałami skierowanymi przeciwko poszukiwanemu antygenowi. Następnie należy zablokować możliwość niespecyficznego wiązania do przeciwciał na podłożu stałym. W tym celu inkubuje się płytkę z roztworem albuminy lub odtłuszczonego mleka w proszku. Do tak przygotowanych studzienek dodaje się badaną próbę. Poszukiwane białko podczas inkubacji zostanie wychwycone i związane z przeciwciałem. Po wypłukaniu antygenów, które nie związaly się z fazą stałą płyki dodawane są przeciwciała II-rzędowe skierowane przeciwko badanym białkom, jednak wiążące się w innym miejscu. Przeciwciała II-rzędowe mogą być znakowane chemiluminescencyjnie lub enzymem. W przypadku stosowania enzymu jako znacznika należy przeprowadzić dodatkowy etap reakcji. Polega on na dodaniu substratu do mieszaniny i wystąpienia reakcji barwnej. Najczęsciej stosowane enzymy do znakowania w teście ELISA to peroksydaza chrzanowa, fosfataza alkaliczna i oksydaza glukozowa. Powstały kompleks przeciwciało-antygen-przeciwciało określany jest mianem „kanapki“ a opisana wyżej metoda – „kanapkowym“ testem ELISA.
Z uwagi na wysoką czułość i możliwość uzyskania wyniku ilościowego, test ELISA znajduje szerokie zastosowanie w diagnostyce medycznej. Rutynowo wykorzystywana jest w mikrobiologii lekarskiej i diagnostyce weterynaryjnej, a także badaniach immunologicznych, serologicznych, toksykologicznych oraz onkologicznych.
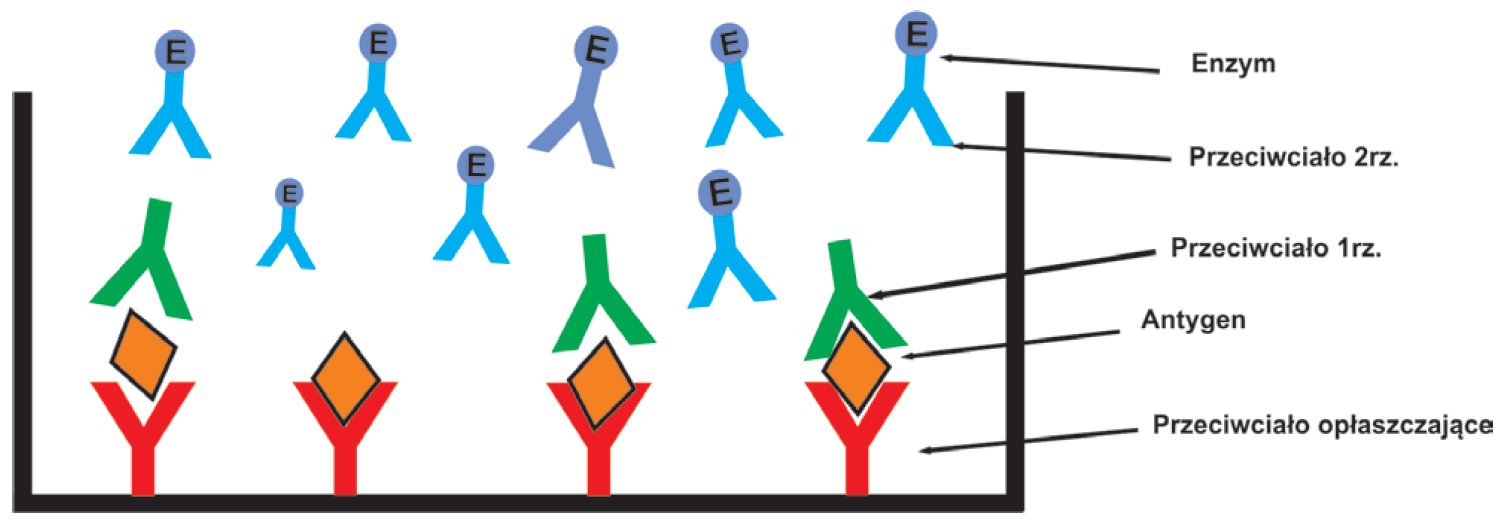
Rycina B. Mechanizm działania „kanapkowego“ testu ELISA.
Immunoturbidymetria i immunonefelometria
Mechanizm działania metody immunoturbidymetrycznej i immunonefelometrycznej opiera się na zasadzie, że w precypitującym roztworze kompleks antygen-przeciwciało powoduje jego zmętnienie i w konsekwencji większe rozproszenie wiązki światła niż w przypadku roztworu natywnego. Dzięki założeniu, że natężenie światła rozproszonego jest wprost proporcjonalne do stężenia cząstek rozpraszających, możliwe jest wykorzystanie pomiaru natężenia światła rozproszonego do określenia stężenia antygenu (poszukiwanego białka) w analizowanym roztworze. Metoda immunonefelometryczna polega na pomiarze natężenia światła rozproszonego przez badany roztwór (dektor znajduje się pod kątem 90° w stosunku do wiązki światła), natomiast metoda immunoturbidymetryczna opiera się na pomiarze natężenia światła przechodzącego przez badany roztwór (detektor położony jest na wprost wiązki światła). Kluczowe jest odpowiednie przygotowanie próbki, czyli jej rozcieńczenie. Analiza zbyt gęstego roztworu może prowadzić do uzyskania fałszywie zaniżonych wyników ze względu na powstawanie zbyt wielu kompleksów, co uniemożliwia swobodne przejście wiązki światła. Odczyt wyniku następuje w oparciu o krzywą kalibracyjną. Należy pamiętać, że odczytu wyniku zmętnienia można dokonać jedynie w liniowym zakresie precypitacji według krzywej Heidelberga, czyli przy nadmiarze przeciwciał.
Rutynowo metodą immunonefelometryczną i immunoturbidymetryczną oznacza się stężenia albuminy, składowych dopełniacza C3 i C4, haptoglobiny, ceruloplazminy, transferryny, immunoglobulin IgG, IgM, IgA, łańcuchów lekkich immunoglobulin, β2-mikroglobuliny, apolipoprotein w materiale biologicznym obejmującym właściwie wszystkie płyny ustrojowe człowieka.
Immunofiksacja
Podczas rozważań o metodach oznaczania białka w materiale biologicznym nie sposób pominąć metody wykorzystywanej rutynowo do detekcji białka monoklonalnego – immunofiksacji. Jest to najdokładniejsza technika bazująca nam rozdziale elektroforetycznym stosowana w immunologii. Metoda ta polega na immunoprecypitacji antygenów in situ po rozdziale elektroforetycznym w żelu agarozowym. Badany materiał rozdzielany jest w kilku ścieżkach żelu, tak aby w każdej z nich otrzymać po elektroforezie identyczny rozdział. Nastepnie powierzchnia każdej ze ścieżek (oprócz jednej, która stanowić będzie punkt odniesienia) pokrywana jest przeciwciałem celowanym w konkretną frakcję białka. Dyfundują one w głąb żelu i dochodzi do utworzenia immunoprecypitatów z odpowiednimi antygenami. Po wypłukaniu nadmiaru niezwiązanych przeciwciał żel suszy się i wybarwia. Reakcja barwna ujawni jedynie te białka, które uległy immunofiksacji w wyniku immobilizacji w żelu przez związanie z przeciwciałem. Dowodzi to obecności lub braku) poszukiwanego antygenu w materiale badanym.
Immunofiksacja stosowana jest do identyfikacji i charakterystyki dysprotein oraz patologicznych immunoglobulin. Najbardziej znanym zastosowaniem tej metody w rutynowej diagnostyce jest detekcja białka monoklonalnego u pacjentów ze szpiczakiem mnogim.
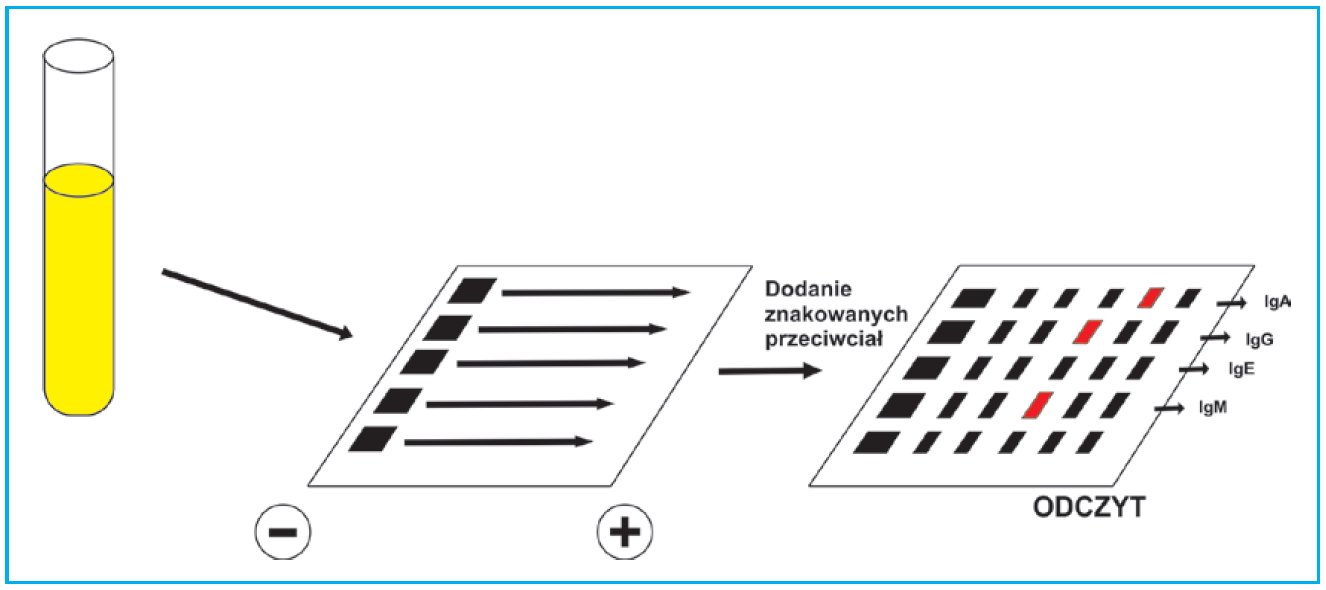
Rycina C. Schemat techniki immunofiksacji.
Mikromacierze białkowe
Jedną z najnowocześniejszych metod służących do identyfikacji białka są mikromacierze białkowe, zwane również „chipami“ białkowymi. Mikromacierz to płytka o powierzchni kilku centymetrów kwadratowych, na której naniesione są w ściśle określonych miejscach mikroskopijnej wielkości pola, zawierające panel białek, najczęściej przeciwciał skierowanych przeciwko poszukiwanym białkom. Po nałożeniu materiału na płytkę mikromacierzy następuje związanie się białek (o ile występują) z przeciwciałami. Następnie należy dodać na wszystkie pola przeciwciała sprzężone z fluorochromami, które wiążą się do utworzonego w poprzednim etapie kompleksu. Istnieją trzy rodzaje chipów białkowych. Mikromacierze wychwytujące (ang. capture arrays) opierają się na wspomnianej wcześniej reakcji pomiędzy przeciwciałem na płytce i poszukiwanym białkiem. O mikromacierzach odwrotnych (ang. reverse arrays) mówi się, gdy na płytkę naniesiony jest badany lizat białkowy. Pomiar białek następuje po dodaniu wyznakowanych przeciwciał. Ostatnim typem są mikromacierze czynnościowe (ang. functional arrays) umożliwiające badanie interakcji pomiędzy białkami. Wynik ilościowy i jakościowy odczytywany jest przez detektor fluorescencyjny.
Technologia mikromacierzy stała się kluczowym narzędziem dla badań z zakresu proteomiki. Dzięki miniaturyzacji rozmiarów płytki i maksymalizacji wykorzystania powierzchni jest obiecującym narzędziem do diagnostyki białek. Pozwala na szybkie, wydajne i równoległe wykrywnie tysięcy różnych białek na jednej płytce. Mikromacierze mogą również z czasem wkroczyć do rutynowej diagnostyki medycznej ze względu na zmniejszenie ilości potrzebnego materiału klinicznego i wykorzystywanych odczynników. Drugą zaletą jest znaczne przyspieszenie całego procesu analitycznego co jest szczególnie ważne w diagnostyce laboratoryjnej materiału pochodzącego od pacjentów. Istotny jest również fakt, że niewielki chip białkowy może jednocześnie odpowiedzieć na tysiące pytań dotyczacych stanu zdrowia pacjenta.
Obecnie dostępne są już mikromacierze wykrywające jednocześnie przeciwciała przeciwko różnym antygenom HIV-1, HIV-2 oraz wirusów zapalenia wątroby. Znajdują także zastosowanie w identyfikacji markerów nowotworowych.
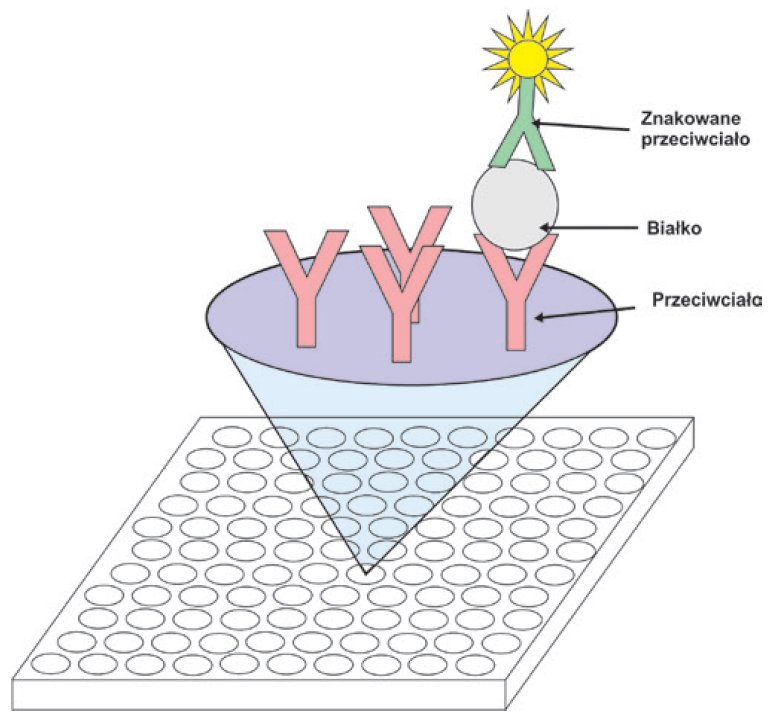
Rycina D. Mikromacierz białkowa – zasada metody.
Spektrometria mas
Spektrometria mas (MS, ang. mass spectrometry) jest zaawansowaną techniką analityczną, która pod kątem badań proteomicznych pozwala na identyfikację białek w złożonych próbkach materiału biologcznego, ilościową ocenę ich ekspresji, mas cząsteczkowych oraz ustalenie składu aminokwasowego. Analiza białek przy użyciu MS polega na jonizacji cząsteczek w stanie gazowym i następnie ich rozdzieleniu w zależności stosunku masy do. ładunku elektrycznego. Prowadzi to do powstania widma masowego, które jest podstawą do identyfikacji poszukiwanego białka. W proteomice najczęściej wykorzystywane są dwie modyfikacje elementu budowy MS - jonizatora: MALDI (ang. matixassisted laser desorption/ionization) czyli desorpcja laserowa z udziałem matrycy oraz ESI (ang. electrospray ionization) czyli elektrorozpylanie Również wśród analizatorów mas można spotkać wiele modyfikacji. Obecnie najpopularniejszym w badaniach nad proteogramem jest analizator czasu przelotu (TOF, ang. time of flight) w połączeniu z jonizatorem MALDI. TOF pozwala na badanie czasu przelotu jonów między jonizatorem a detektorem, który zależy od wartości stosunku masy do liczby ładunków jonów. Niewątpliwie największą zaletą stosowania modyfikacji MALDI-TOF jest bezpośrednia detekcja składu złożonej mieszaniny białek lub innych cząsteczek.
W dziedzinie proteomiki MALDI-TOF znajduje zastosowanie w identyfikacji białek w złożonym, heterogennym materiale biologicznym, wyznaczaniu mas cząsteczkowych oraz wykrywania modyfikacji potranslacyjnych białek.
PIŚMIENNICTWO:
1. Opiela J.: Analiza ekspresji genów na poziomie białek przy użyciu techniki western-blot. Wiadomości zootechniczne, R. XLIV (2006); 1: 11-13.
2. Wu W., Welsh M.J., Kaufman P.B., Zhang H.H.: Analysis of gene expression at the proteomic level. Gene Biotechnology 2004; CRC Press.
3. Lequin R (2005), Enzyme immunoassay (EIA)/enzyme-linked immunosorbent assay (ELISA), Clin. Chem. 51 (12): 2415–8.
4. S. Leng, J. McElhaney, J. Walston, D. Xie, N. Fedarko, G. Kuchel (October 2008). Elisa and Multiplex Technologies for Cytokine Measurement in Inflammation and Aging Research. J Gerontol a Biol Sci Med Sci 63 (8): 879–84.
5. Torane VP, Shastri JS; Comparison of ELISA and rapid screening tests for the diagnosis of HIV, hepatitis B and hepatitis C among healthy blood donors in a tertiary care hospital in Mumbai; Indian Journal of Medical Microbiology; 2008; 26(3).
6. Chan EL, Sidaway F, Horsman GB: A comparison of the Genie and western blot assays in confirmatory testing for HIV-1 antibody. Journal of Medical Microbiology; 03.1996.
7. Uttamchandani M, Neo JL, Ong BNZ, Moochhala S; Applications of microarrays in pathogen detection and biodefence; Trends in Biotechnology. 2008;53(27):61.
8. Haab BB.,Dunham MJ., Brown PO.: Protein microarrays for highly parallel detection and quantitation of specific proteins and antibodies in complex solutions. Genome Biol. 2001;2:1-13.
9. Krzemiński Z.: Postępy w diagnostyce mikrobiologicznej chorob zakaźnych. Przegl Epidemiol 2003;57: 377-80.
10. Mahmood T., Yang PC.:Western blot: technique, theory, and trouble shooting. N Am J Med Sci. 2012;4(9):429-34.
11. Chandra H., Reddy PJ., Srivastava S.: Protein microarrays and novel detection platforms. Expert Rev Proteomics. 2011 Feb;8(1):61-79.
12. Wieser A., Schneider L., Jung J., Schubert S.: MALDI-TOF MS in microbiological diagnostics-identification of microorganisms and beyond (mini review. Appl Microbiol Biotechnol. 2012 Feb;93(3):965-74.
13. Litwin CM., Anderson SK., Philipps G., Martins TB., Jaskowski TD., Hill HR.: Comparison of capillary zone and immunosubtraction with agarose gel and immunofixation electrophoresis for detecting and identifying monoclonal gammopathies. Am J Clin Pathol. 1999 Sep;112(3) 411-7.





