Sartorius Poland Sp. z o.o.
strony wersji drukowanej: 16-19
strony wersji drukowanej: 16-19
Woda jest głównym składnikiem każdego podłoża stosowanego w hodowli kultur komórkowych. Potrzebna jest do przygotowywania podłoża, roztworów buforowych i substancji dodatkowych. Służy też w zadaniach pomocniczych jak podgrzewanie, chłodzenie, mycie i płukanie. Jakość wody ma zatem ważne znaczenie dla wyników doświadczeń z kulturami komórkowymi.
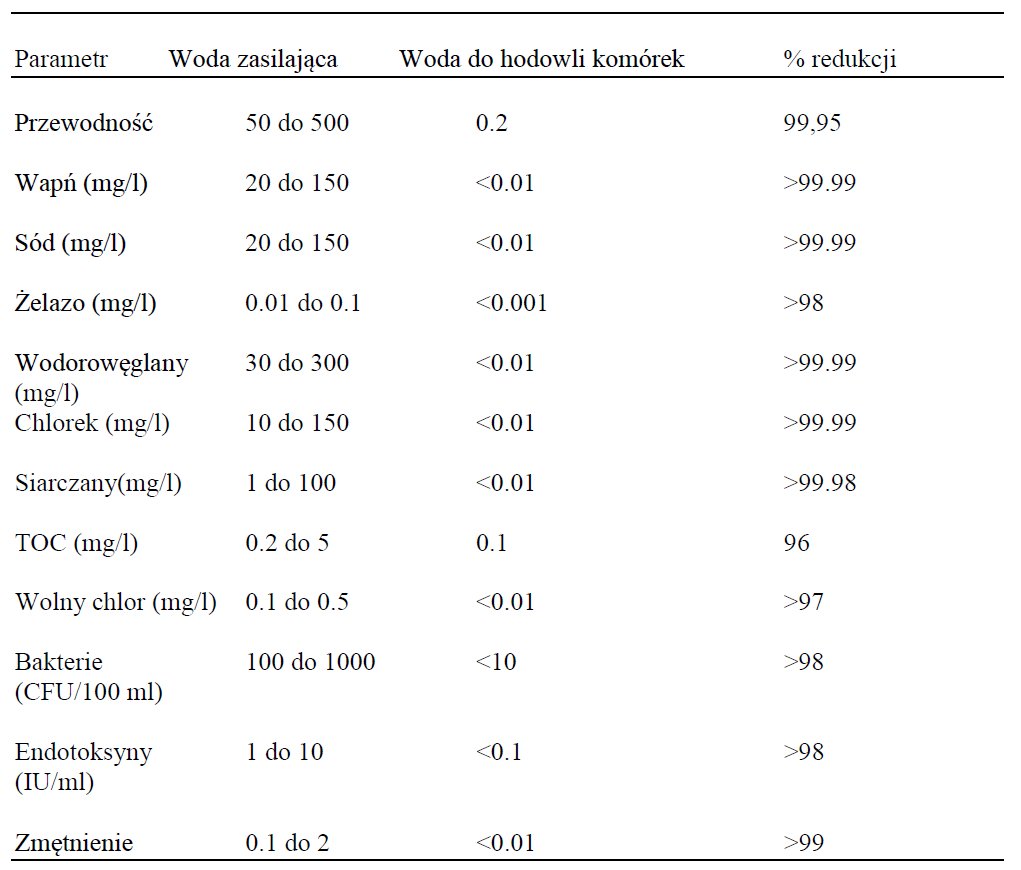
Zanieczyszczenia wody używanej w hodowli kultur komórkowych mogą występować w różnych postaciach takich jak bakterie, drożdże lub pleśnie. Są one widoczne gołym okiem lub w badaniach mikroskopowych. Zanieczyszczenia pochodzące z chemikaliów lub innych biologicznych czynników, zwykle niewidoczne gołym okiem, mogą wpływać na wzrost, morfologię i zachowanie kultur komórkowych. Woda używana w kulturach komórkowych musi zatem być wolna od mikroorganizmów, w szczególności endotoksyn, jonów nieorganicznych (metali ciężkich takich jak ołów, cynk itp.), związków organicznych (kwasów humusowych, tanin, pestycydów itd.). Więcej szczegółowych informacji znajduje się w Przypisach (1,2). Przykłady typowych zanieczyszczeń w wodzie zasilającej i wartości docelowych dla kultur komórkowych zawiera Tabela 1.
Tabela 1: Typowe zanieczyszczenia wody i wyniki końcowe dla kultur komórkowych.
Celem obecnych testów było zbadanie czy ultra czysta woda wyprodukowana przez system Arium pro UF może być stosowana w hodowli kultur komórkowych bez jakichkolwiek problemów. W niniejszym badaniu wyhodowaliśmy komórki PER.C6 EpCAM na gotowym podłożu CDM4PERMab (Hyclone) jako grupę kontrolną, oraz na podłożu proszkowym CDM4PPERMab (Hyclone) przygotowanym z użyciem zarówno ultra czystej wody pobranej z Arium pro UV (wody UV) jak i wody z RO.
W niniejszym opracowaniu dane przedstawione dla wody z RO otrzymano przy zastosowaniu poprzedniego modelu urządzenia (Arium RO). Wyniki dla każdej z kultur wykorzystano następnie dla oceny czy woda z Arium pro UV jest odpowiednia do hodowli komórek PER.C6 EpCAM.
Linia komórek PER.C6 wyodrębniona z ludzkich retinoblastów, opisana i zastosowana w serii naszych testów, jest także używana obecnie do określenia białek rekombinowanych i przeciwciał monoklonalnych (Mab) jak i dla wytwarzania białek terapeutycznych i przeciwciał monoklonalnych.
System uzyskiwania ultraczystej wody
Urządzenie (Rys. 1) wytwarza ultraczystą wodę z wody zasilającej poprzez usuwanie śladowych poziomów zanieczyszczeń. Produkcja ultraczystej wody wymaga ciągłej recyrkulacji i przepływu wody. Służy temu zastosowanie pompy kontrolującej ciśnienie wody. System mierzy przewodność zarówno wody wlotowej jak i uzdatnionej.

Rys.1. System uzdatniania wody Arium pro UV.
System wykorzystuje dwa zestawy wkładów, wypełnionych specjalnym adsorberem w postaci węgla aktywowanego i żywicy jonowymiennej typu złoże mieszane. Końcowy mikrofiltr jest zwykle instalowany przy wylocie wody uzdatnionej, celem usunięcia resztek cząsteczek lub bakterii z pobieranej ultra czystej wody. Proces uzdatniania wody przedstawia w ogólnym zarysie Rys. 2.
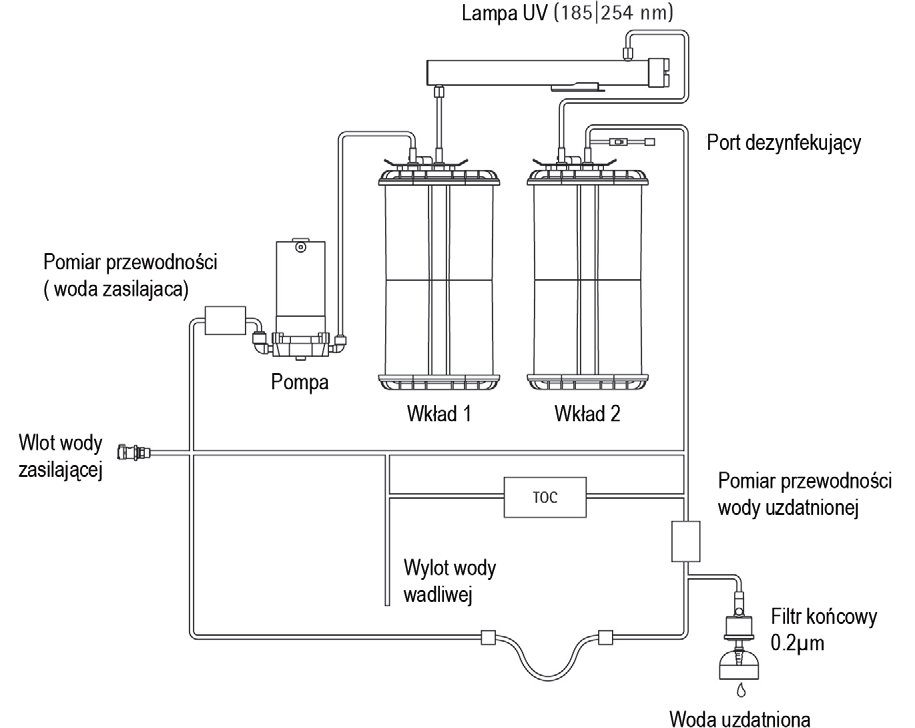
Rys.2 Schemat urządzenia do uzdatniania wody Arium pro UV.
Do przeprowadzenia testów przedstawionych poniżej, woda zasilająca dla urządzenia Arium pro UV (poprzedni model technicznie taki jak aktualny model Arium pro UV przedstawiony na Rys. 1) została wstępnie przefiltrowana drogą odwróconej osmozy w urządzeniu Arium RO. Jest to zgodne z wymogami Whitehead (2) dotyczącymi uzdatniania wody do hodowli kultur komórkowych na niewielką skalę laboratoryjną. System wstępnej filtracji nie jest dalej wyszczególniany w niniejszym opracowaniu.
Materiały i metody
Komórki PER.C6 EpCAM zostały wyhodowane w dwóch kolbach T-75 z kapslami odpowietrzającymi (Nuvic) pozwalającymi na wymianę gazu; (12 ml podłoża w każdej) dla 10 pasaży oraz w 125 ml zlewkach stawianych w wirówkach (Wheaton, VWR) z 50 ml podłożem w każdej z dwóch zlewek. Linia komórek PER.C6 EpCAM została wyhodowana na gotowym podłożu CDM4PERMab (Hyclone) oraz na podłożu proszkowym CDM4PERab (Hyclone). Podłoże proszkowe CDM4PERMab zostało rozpuszczone wodą UV lub wodą z RO, wraz z 4mH L-glutaminianem (Lonza), węglanem sodu (3,2 g/l, Merck) oraz kwasem plutonowym F-68 (0,5 g/l, Sigma) a następnie przefiltrowane w sterylnych warunkach przez filtr końcowy 0.2µm, z użyciem 1000 ml zestawów filtracyjnych.
Komórki zostały wysiane z gęstością 0,3 x 10 komórek/ml w kolbach T-75 oraz 0,7 x 10 komórek/ml w zlewkach do wirówek Kolby T oraz zlewki były inkubowane w inkubatorach z CO (bezpośrednie grzanie w inkubatorze, Model 3-11 Thermo Scientific) w temperaturze 37°C, 5 % CO i przy wilgotności 85%. Zlewki w inkubatorze z CO były inkubowane w mieszadle magnetycznym (VWR), o obrotach 80 rpm. Boczne ramiona każdej zlewki były niedomknięte w celu ułatwienia wewnętrznej wymiany gazu. W celu określenia gęstości żywych komórek, próbki pobierano ze zlewek do wirówek każdego dnia, z wyjątkiem weekendów (4 i 5 dzień) a z kolb T co trzeci dzień. Gęstość żywych komórek była mierzona metodą Trypan Blue przy użyciu hemacytometru (Vasa Sciewntific). Obszerniejsze informacje na temat podstawowych technik hodowli komórek znajdują się w Przypisach (3).
Wyniki i dyskusja
Średnia gęstość komórek w kontrolnych kolbach T (komórki hodowane na gotowym, kontrolnym podłożu) wyniosła 1,52x 10 komórek/ml a średnia żywotność 95,23%. W przypadku komórek w kolbach T, hodowanych na podłożu rozpuszczonym wodą UV, średnia gęstość wyniosła 1,73x10 komórek/ml a żywotność 95,7%. Dla porównania, średnia gęstość komórek wyhodowanych na podłożu rozpuszczonym wodą z RO wyniosła 1,68 x 10 komórek/ml a żywotność 95,59%.
W kolejnym doświadczeniu wyhodowano linię komórek PER.CV6 EpCAM w zlewkach do wirówek, na gotowym, kontrolnym podłożu oraz na podłożu rozpuszczonym wodą UV i wodą z RO. Maksymalna gęstość komórek w kontrolnych zlewkach wyniosła 5,42 x 10 komórek/ml a żywotność 88,47 %. Analogiczne wartości dla zlewek z podłożem rozpuszczonym wodą UV wyniosły 6,24 x 10 komórek/ml i 88,55 % dla podłoża z użyciem wody z RO : 4,60 x 10 komórek/ml i żywotność 89,85%. Dane dotyczą 6 dnia hodowli. Badanie mikroskopowe komórek wyhodowanych w zlewkach do wirówek o podłożu z użyciem wody z RO wykazały, że komórki tak wyhodowane wyglądały niezdrowo w porównaniu z komórkami wyhodowanymi na gotowym podłożu jak i na podłożu rozpuszczonym wodą UV. Żywotność komórek w zlewkach ustawianych w wirówkach, wyhodowanych na podłożu rozpuszczonym wodą z RO spadała szybciej niż komórek wyhodowanych na gotowym podłożu czy na podłożu rozpuszczanym wodą UV. Takiego spadku nie odnotowano w przypadku hodowli w kolbach T. Gwałtowny spadek żywotności komórek w zlewkach do wirówek można przypisać obecności endotoksyn i soli nieorganicznych obecnych w wodzie z RO, negatywnie wpływających na wzrost i żywotność komórek. Tak negatywnego wpływu endotoksyn i soli nieorganicznych nie zaobserwowano w przypadku kultur statycznych (na małą skalę) hodowanych w kolbach T. Wynika to z faktu, że wzrost jest tu ograniczony stężeniem O w podłożu a nie koncentracją endotoksyn czy soli nieorganicznych (nie przedstawia się typowej krzywej wzrostu dla kolb T w porównaniu z kulturami w zlewkach ustawianych w wirówkach).
Efekty te można zaobserwować jedynie w przypadku hodowli w zlewkach stawianych w wirówkach, gdzie wystąpiła większa gęstość komórek a O nie było czynnikiem ograniczającym. Większa koncentracja endotoksyn i soli nieorganicznych w podłożu rozpuszczonym w wodzie z RO spowodowała zmniejszenie tempa wzrostu (niższa gęstość i żywotność komórek) w porównaniu z podłożem kontrolnym (gotowym do użycia) jak i w przypadku próbek wyhodowanych na podłożu rozpuszczonym w wodzie UV. Wyniki te zostały potwierdzone ilością przeciwciał (Mab). Ich produkcja w zlewkach stawianych w wirówkach, zawierających komórki hodowane na podłożu rozpuszczonym wodą UV wyniosła 0,84 mg/ml (8 dnia hodowli). Jest ona wyższa niż w przypadku przeciwciał Mab uzyskanych z gotowego podłoża kontrolnego (0,71 mg/ml) lub z podłoża rozpuszczonego w wodzie z RO (0,42 mg/ml).
Wydajność komórek tj. produkcja przeciwciał Mab w kolbach T nie była mierzona gdyż ilość przeciwciał była zbyt niska dla rzetelnych porównań statystycznych.
Wnioski
Powyższe wyniki wyraźnie dowodzą, że odwodnione podłoże (CDM4PERMab) rozpuszczone w wodzie UV zastosowane zamiast gotowego handlowo dostępnego podłoża, jest odpowiednie do hodowli linii komórek PER.C6 EpCAM Charakterystyki wzrostu linii komórek PER.C6 EpCAM, hodowanych na podłożu rozpuszczonym wodą UVsą analogiczne do wyników dla linii komórek PER.C6 EpCAM hodowanych na kontrolnym, gotowym podłożu CD-M4PERMab.
W przypadku kiedy doświadczenia były przeprowadzane w zlewkach umieszczanych w wirówkach, zaobserwowano lepszy wzrost linii komórek w próbkach hodowanych na podłożu rozpuszczonym wodą UV niż w próbkach hodowanych na podłożu rozpuszczonym wodą z RO. Stwierdzono też wyższą gęstość komórek a O nie było czynnikiem ograniczającym. Stwierdzamy zatem, iż większe stężenie endotoksyn lub soli nieorganicznych w wodzie z RO powodowało obniżenie wzrostu.
Wyniki te zostały potwierdzone produkcją przeciwciał Mab w linii komórek PER.C6 EpCAM, wyhodowanych w zlewkach umieszczanych w wirówkach. Produkcja przeciwciał Mab z linii komórek PER.C6 była najwyższa przy zastosowaniu ultraczystej wody z Arium pro UV. Kolejno przeciwciał z gotowego podłoża kontrolnego. Natomiast wartości uzyskane dla próbek z użyciem wody z RO były mniejsze.
Biorąc powyższe pod uwagę, należy stwierdzić, że urządzenie Arium pro UV jest znakomitym systemem do hodowli komórek PER.C6 EpCAM gdyż pozwala na zminimalizowanie zawartości zanieczyszczeń w uzyskiwanej wodzie takich jak jony nieorganiczne, związki organiczne a w szczególności zredukowanie endotoksyny do wyjątkowo niskiego poziomu. Udowodniły to także nowsze badania (pkt.4).
Przypisy:
1. ASTM Standard Guide for Bio Applications Grade Water D 5196-06
2. Whitehead P.: Water Purity and Regulations, in Medicines from Animal Cell Culture (eds.Stacey, G and Davis,J) John Wiley & Sons,Ltd (2007)
3. Freshney I.R,: Culture of Animal Cells-A Manual of Basic Technique and Specialized Applications-6th editio, John Wiley & Sons, Inc,USA (2010)
4. Schmidt K und Herbig E.: „Weniger ist mehr- Quantitative Endotoxinbestimmung von Reinstwasser”, Laborpraxis,5,36.Jhg., (2012)
Autorzy:
Anil Kumar Rathod, Sheokant Diwakar & Dr.Ashok Mundrigi, R&D, Sartorius Stedim India Pvt Ltd, Bangalore, India Dr.Elmar Herbig, Sartorius, Goettingen, Germany.
Kontakt:
Sartorius Poland Sp. z o.o.
Lab Products & Services
Dział Produktów Laboratoryjnych oraz Serwisu
ul. Wrzesińska 70
62-025 Kostrzyn Wlkp.
Tel.: 0048 61 647 38 30
Fax: 0048 61 647 38 39
Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.





