Wojciech Strożek
Adamed Grupa, Dział Badawczy
strony wersji drukowanej: 4-10
strony wersji drukowanej: 4-10
W każdym leczeniu zaburzeń zdrowotnych, pożądane jest, aby lek docierał do miejsca działania w określonym stężeniu oraz aby terapeutyczna dawka pozostała niezmienna przez wystarczająco długi czas, niezbędny do osiągnięcia żądanego efektu. W rzeczywistości jednak, działanie środków farmaceutycznych ograniczone jest przez różne czynniki (degradacja związków przed osiągnięciem celu; działanie na inne komórki; niezdolności do penetracji tkanek wynikająca z natury chemicznej). Z tych powodów poszukiwane są nowe rozwiązania, charakteryzujące się zwiększoną odpowiedzią farmakologiczną. Jednym z takich rozwiązań jest stosowanie układów nośnikowych opartych na polimerach. Stanowią one odpowiednie narzędzie do kontrolowanego dostarczania leku. Mechanizmy związane z kontrolowanym uwalnianiem wymagają stosowania polimerów o różnych właściwościach fizykochemicznych. Do najbardziej znanych układów polimerowych, które znalazły zastosowanie w systemach dostarczania leków należą: nano- i mikro cząsteczki, dendrymery, nano- i mikrosfery, kapsosomy i micele. W tych układach leki mogą być koniugowane (przyłączane) bądź zamykane w matrycy polimerowej. Wszystkie te układy znajdują szerokie zastosowanie w wielu terapiach przeciwnowotworowych, przeciwzapalnych, przeciwbakteryjnych czy też w uzupełnieniu do szczepionek.
Terapia konwencjonalna
Ludzkie zdrowie narażone jest na liczne choroby o charakterze autoimmunologicznym, neurodegeneracyjnym, metabolicznym czy nowotworowym. Wszystkie te choroby są niezwykle trudne do leczenia z wykorzystaniem tradycyjnych leków. Konwencjonalna farmakologia oparta jest na lekach, których wchłanianie i biodostępność zależy od czynników, takich jak rozpuszczalność, pKa, masa cząsteczkowa, liczba wiązań wodorowych i stabilność chemiczna. Każdy z tych czynników ma wpływ na odpowiedź terapeutyczną danej terapii. Stosunkowo mała masa cząsteczkowa konwencjonalnych farmaceutyków, nadaje im zdolność penetracji różnych kompartmentów. Efektem tego jest akumulacja w licznych komórkach i organellach, dlatego też takie leki stosowane są w leczeniu wszelkich chorób. Niestety taki rozkład stężenia niesie ze sobą występowanie skutków ubocznych oraz konieczność stosowania większych dawek do wywołania żądanego efektu. Naukowcy nieustannie prowadzą badania nad nowymi preparatami, które zapewniłyby lepszą odpowiedź farmakologiczną przy mniejszej dawce, co w konsekwencji zminimalizowałoby efekty uboczne.
Systemy dostarczania leków
Bardzo powolny rozwój skutecznych terapii dla niektórych schorzeń, stał się siłą napędową do poszukiwania nowych, interdyscyplinarnych rozwiązań nad precyzyjnym dostarczaniem leku. Niektóre ze stosowanych leków mają optymalny zakres stężeń, w którym osiągany jest maksymalny efekt terapeutyczny. Stężenie leku powyżej lub poniżej tego zakresu skutkuje nadmierną toksycznością lub brakiem jakiegokolwiek efektu. Prace nad kontrolowaną farmakokinetyką, farmakodynamiką, niespecyficzną toksycznością, immunogennością i biorozpoznaniem przyczyniły się do opracowania nowej strategii opartej na systemach dostarczania leków (Drug Delivery System, DDS). Systemy dostarczania leków to takie, których elementy składowe (składniki formulacji lub nośniki) zapewniają precyzyjne dystrybuowanie lub/i czasowe uwalnianie cząsteczek aktywnych w miejscu docelowym. Jest to nowe podejście, które oparte jest na połączeniu farmakologii z nauką o polimerach, analityką, chemią koniugacji i biologii molekularnej. Takie rozwiązanie ma ogromny wpływ na efektywność danej terapii.
Integralnym elementem systemów dostarczania leków są wielkocząsteczkowe nośniki takie jak namo- i mikro-kapsułki, kapsosomy (polimerowe kapsułki wypełnione liposomami), liposomy, micele lub dendrymery, do których przyłączone są molekuły leku (rysunek 1). [1-3]
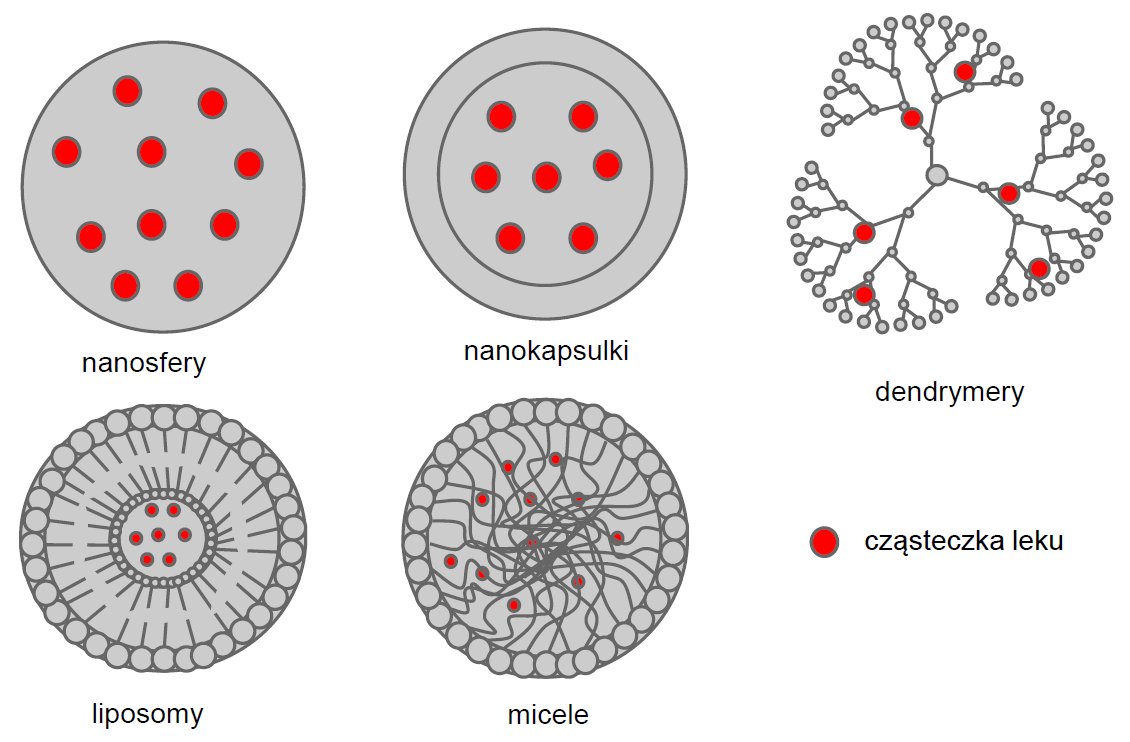
Rysunek 1. Schematy struktur różnych nośników.
Głównym zadaniem nośników polimerowych jest transport leku do miejsca działania. Połączenie nośnik-lek pełni również funkcję ochronną przed interakcją niespecyficznych molekuł, które mogą reagować z dostarczaną cząsteczką i zmieniać ją strukturalnie obniżając tym samym jej efektywność. Ponadto, polimerowe nośniki zapewniają zmniejszone oddziaływanie z makrocząsteczkami (białkami), które mogą maskować składnik aktywny, przez co zaburzone zostaje precyzyjne dostarczanie do celu molekularnego.
Ważnym elementem w przypadku stosowania nośników polimerowych jest zaprojektowanie odpowiedniego typu struktury polimerowej (uwzględniając stopień hydrofobowości, czy ilość wiązań kowalencyjnych pomiędzy monomerami), która umożliwi uwolnienie leku w określonych warunkach. Manipulacje w obrębie struktury chemicznej polimeru mogą znacząco wpływać na szybkość i stopień uwalniania leku. Innym rozwiązaniem jest zastosowanie odpowiednich linkerów, czyli cząsteczek łączących lek z polimerem. Takie linkery mają zawarte w swojej strukturze fragmenty, które ulegają degradacji w określonych warunkach (środowisko o obniżonym pH, obecność specyficznych enzymów trawiennych).
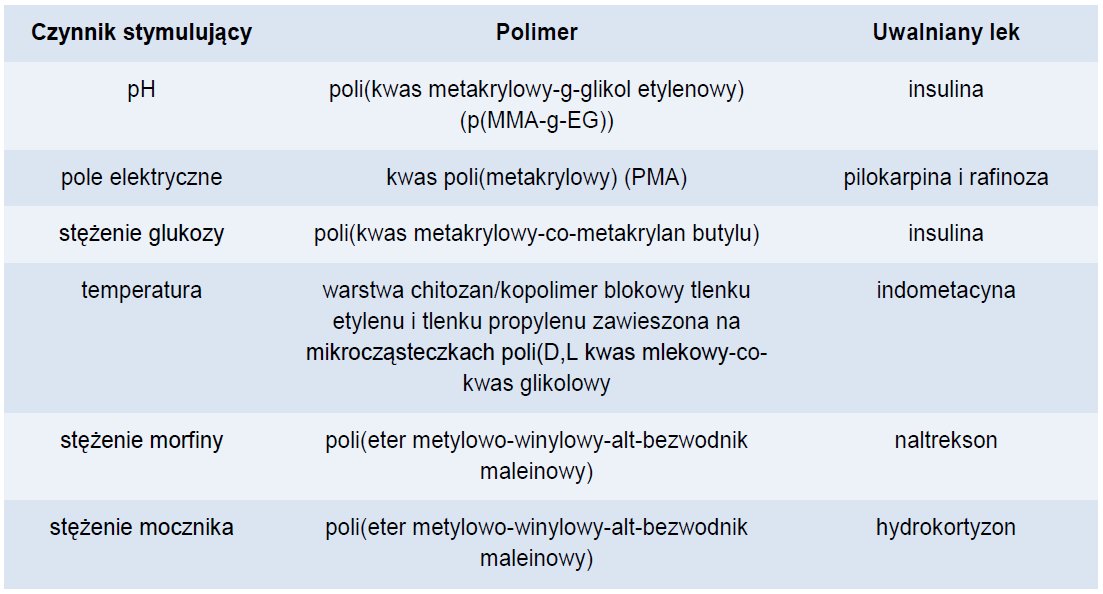
Inną, nowatorską strategią jest zastosowanie tak zwanych inteligentnych polimerów, których stymulacja różnymi czynnikami (temperatura, pH, wilgotność, działanie pola elektrycznego lub magnetycznego itp.) indukuje zmianę w strukturze, co powoduje uwalnianie leku. Przykłady inteligentnych polimerów zestawiono w tabeli 1. [4]
Tabela 1. Przykłady inteligentnych polimerów.
Tabela 1. Przykłady inteligentnych polimerów.
Metody pozyskiwania nanocząstek polimerowych
Pierwszymi polimerowymi cząsteczkami opracowanymi w latach 1960/70 były micele. Micele są to kuliste supramolekularne nanoagregaty o hydrofobowym rdzeniu i hydrofilowej otoczce, powstające w wyniku polimeryzacji (samoorganizacji) makrocząsteczek, w tym amfifilowych kopolimerów blokowych (Rysunek 1).
Podział nośników polimerowych na nano/mikrokapsułki i nano/mikrosfery uwarunkowany jest rozmiarem oraz strukturą cząsteczki. Za drobne cząstki uznaje się te o wielkości od 100 do 2500 nm, zaś najdrobniejsze cząsteczki to takie, których wielkość mieści się w zakresie od 1 do 100 nm.
Rozwój zaawansowanych technik polimeryzacji oraz stosowanie różnych środków powierzchniowo czynnych był naturalnym etapem wytwarzania i stabilizacji polimerowych nanocząsteczek. Znane są liczne metody pozyskiwania nanocząsteczek polimerowych.
Tworzenie nanocząsteczki typu lek-polimer odbywa się przez rozpuszczenie leku i polimeru w niemieszających się z wodą organicznych rozpuszczalnikach. Następnie przy użyciu sondy ultradźwiękowej otrzymuje się nano emulsje. Kolejnym etapem jest usunięcie rozpuszczalnika organicznego, które odbywa się przy użyciu wyparki obrotowej w warunkach podwyższonej temperatury i obniżonego ciśnienia. Znane są również liczne zmiany i udoskonalenia techniki emulgacji. Na przykład, metoda sonikacji uznawana jest za krytyczny etap w tworzeniu wrażliwych nanoemulsji typu lek-polimer. Dzieje się tak dlatego, że proces sonikacji znacząco zwiększa temperaturę, co może prowadzić do inaktywacji reaktywnych składników. W celu zminimalizowania tego problemu stosuje się cyklizację procesu dzięki czemu utrzymana zostaje niska temperatura. Inne przykłady otrzymywania kompleksu lek-polimer przedstawiono na rysunku 2. Biodegradowalne polimerowe nanocząsteczki są powszechnie wytwarzane przez takie techniki jak: odparowanie rozpuszczalnika z wodnej emulsji, przemieszczenie rozpuszczalnika, wysalanie, dyfuzja rozpuszczalnika z jednofazowego roztworu, odparowanie rozpuszczalnika z podwójnej emulsji.
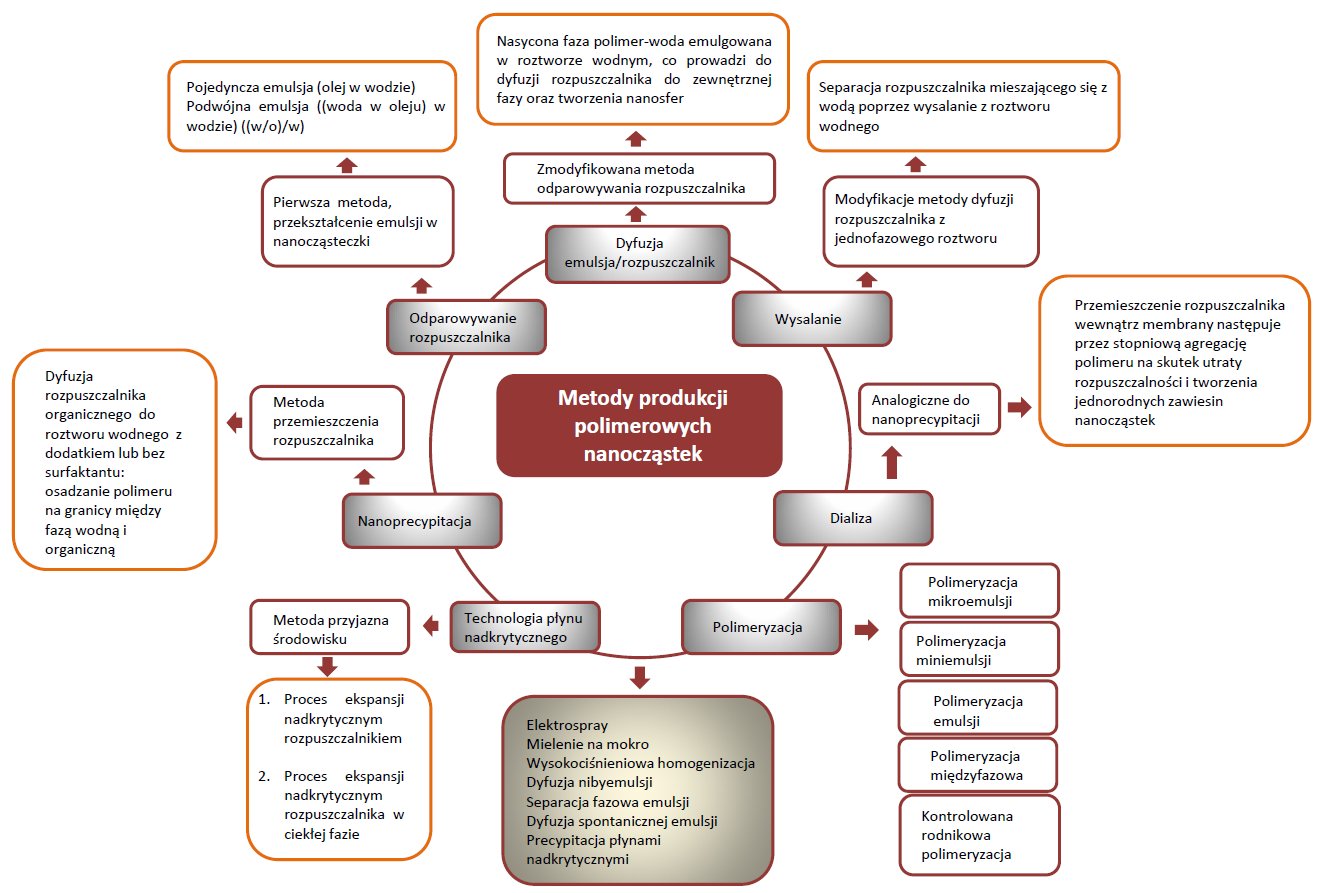
Rysunek 2. Metody pozyskiwania polimerów.
Kolejnym bardzo istotnym aspektem są ciągłe prace nad sposobami zmniejszenia wielkości cząstek do rozmiarów nanometrów. Często stosowanymi technikami, które redukują wielkość jest wysokociśnieniowa homogenizacja lub mielenie złoża na mokro. Najefektywniejsze wyniki zmniejszania rozmiarów cząstek osiąga się właśnie przy użyciu wysokociśnieniowej homogenizacji (która jednak wymaga zastosowania wyspecjalizowanego sprzętu odpornego na rosnące ciśnienie i temperaturę). Ostatecznym etapem otrzymywania nanocząsteczek polimerowych (lek-polimer) jest ich suszenie. W tym celu naukowcy opracowali kilka technik suszenia preparatów. Do najważniejszych należą: liofilizacja atmosferyczna, liofilizacja rozpyłowa, liofilizacja próżniowa. Niestety techniki liofilizacji są jednym z głównych powodów agregacji.Główną wadą polimeryzacji są toksyczne, reaktywne reszty nieprzereagowanych monomerów. Zastosowanie gotowych polimerów pozwoliło niemal całkowicie rozwiązać ten problem. [5-12]
Biomateriały w systemach dostarczania leków
Początkowo polimery wykorzystywane były w niebiologicznych układach i wybierane były ze względu na swoje właściwości np.: poliuretany (właściwości elastyczne); polisiloksany lub silikony (zdolności izolacyjne); polimetakrylan metylu (duża wytrzymałość fizyczna i przejrzystość); polialkohol winylowy (wytrzymały i hydrofilowy); polietylen (duża odporność na działanie kwasów, zasad i niską temperaturę). Cząsteczki polimerowe stosowane do kontrolowanego podawania leków muszą charakteryzować się chemiczną obojętnością, czystością oraz odpowiednią strukturą, którą można swobodnie przetwarzać. Poniżej podano kilka przykładów takich polimerów: polimetakrylan hydroksyetylowy; poli(N-winylopirolidon); poli(metakrylan metylu); poli(alkohol winylowy);poli(kwas akrylowy); poliakrylamid; poli(etylen-co-octan winylu)); poli(tlenek etylenu); poli(kwas metakrylowy). W terapii celowanej najlepiej rokujące polimery to: polilaktydy (PLA); poliglikolidy (PGA); poli(laktydo-ko-glikolidy) (PLGA); polibezwodniki i poliortoestry. Początkowo, polilaktydy i poliglikolidy używane były, jako wchłanialne nici chirurgiczne i naturalnym krokiem było zastosowanie tych polimerów w systemach dostarczania leków. Największą zaletą tych degradowalnych polimerów jest ich rozkład na molekuły, które są w sposób naturalny metabolizowane i usuwane. [13,14]
Koniugaty terapeutyczne
Atrakcyjną grupą preparatów są koniugaty polimerów ze związkiem małocząsteczkowym (efektorowym), w których cząsteczka leku związana jest z polimerem poprzez linker (łącznik) wrażliwy na działanie enzymów trawiennych lub obniżone pH lizosomalne (kontrolowana dystrybucja). Ten rodzaj uwalniania jest stosowany przez nanocząsteczki, które mają wysoką mobilność w najdrobniejszych naczyniach włosowatych, umożliwiając tym samym skuteczną absorpcję i selektywne gromadzenie się leku w miejscach docelowych. Taki typ nanocząsteczek znalazł zastosowanie w chorobach nowotworowych. Dostarczanie leku za pośrednictwem takich układów może być zarówno aktywny jak i pasywny. Ten ostatni odnosi się do transportu przez nieszczelne kapilary naczyń krwionośnych w obrębie guza nowotworowego (pasywna dyfuzja). Prowadzi to w komórkach do akumulacji nanocząstek z powodu zwiększonej przepuszczalności i retencji - EPR (enhanced permeability and retention). Transport aktywny wymaga użycia sprzężonej reszty targetującej w celu zwiększonej dystrybucji leku w konkretnym miejscu.
Makromolekuła, która dotrze do nowotworowej komórki docelowej ulega endocytozie (endocytoza za pośrednictwem receptora) lub fagocytozie (internalizacja bez udziału receptora) przez pęcherzyk zwany endosomem. Wykorzystując fakt, iż w tych pecharzykach pH jest niższe (6.5-5.0) niż w macierzy zewnątrzkomórkowej (7.2-7.4) linkery w sposób kontrolowany mogą ulegać hydrolizie w celu uwolnienia leku. Następnie endosom jest absorbowany przez kolejny pęcherzyk - lizosom,zawierający liczne enzymy trawienne aktywne w niskim pH (pH lizosomów 4.0). Niektóre badania wykazały nadekspresję pewnych enzymów w tkance nowotworowej. Może to być stosowane w celu uzyskania kontrolowanego uwalniania związku w przypadku stosowania linkera wrażliwego na te enzymy. Ponadto pH tkanki nowotworowej jest nieco niższe niż w zdrowej tkance, a tym samym kontrolowane uwalnianie leku można również uzyskać przy stosowaniu linkera nietrwałego w środowisku kwaśnym; w tym przypadku lek jest uwalniany na poziomie zewnątrzkomórkowym.
Jak już wcześniej wspomniano, cząsteczki terapeutyczne mogą być kowalencyjnie przyłączone do struktury polimeru. W koniugatach typu lek-polimer, głównym celem jest ulepszenie mechanizmu internalizacji i specyficzności komórkowej, co pozwoli na optymalne uwolnienie leku w obrębie celu molekularnego. Dla porównania systemy, w których substancje aktywne są osadzone lub kapsułkowane wewnątrz polimerów dążą do zwiększenia dystrybucji, stabilności w surowicy, oraz zmniejszenia immunogenności. Jak dotąd kilka koniugatów lek-polimer weszło do fazy badań klinicznych. Niektóre z koniugatów, takie jak: kopolimery HPMA (N-(2-hydroksypropylo)metakrylamidu) oparte na doksorubicynie i galaktozaminie (PK2) Rysunek 3; kopolimery HPMA pochodnych platynowych (AP 5346); poliglutaminian paklitakselu (Xyotac); PEG-SN38 (EZN-2208); poliglutaminian kamptotecyny (CT-2106) czy kamptotecyna połączona do cyklodekstryny (CT-2106) są w zaawansowanej fazie badań klinicznych i stanowią grupę terapeutyków przeciwko chorobie nowotworowej.[15-17]
Konkluzje
W ciągu ostatnich kilku dekad polimery osiągnęły niezwykły rozwój. Znalazły one szerokie zastosowanie w medycynie a w szczególności w innowacyjnych systemach dostarczania leków. Korzyści płynące ze stosowania polimerów wynikają przede wszystkim z tego, iż polimery wykazują lepszy profil farmakokinetyczny w porównaniu z molekułami drobnocząsteczkowymi. Oprócz dłuższego czasu trwania w krążeniu, wykazują również wysoki potencjał w stosunku do docelowych tkanek. Synteza nowych bloków, kopolimerówi projektowanie nowych kombinacji polimerów będzie dotąd ulepszać systemy dostarczania leków aż osiągnięty zostanie najdoskonalszy profil biodostępności i kontrolowanego uwalniania.
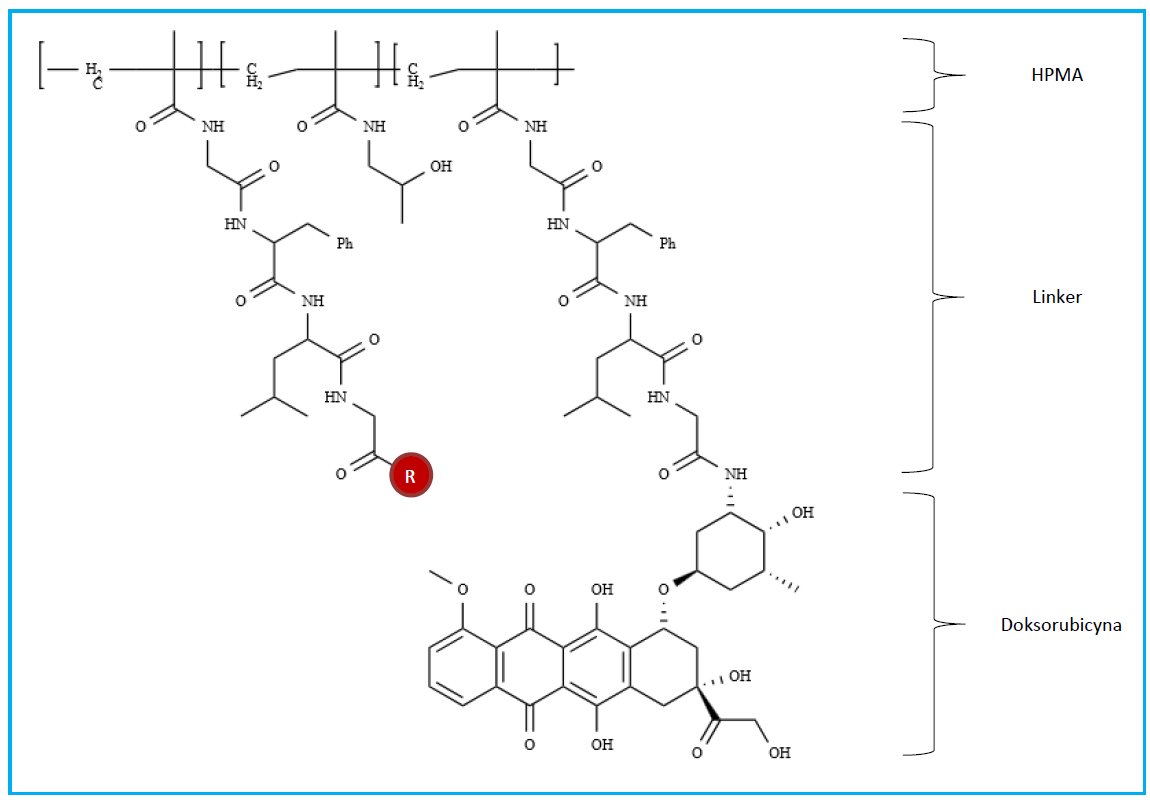
Rysunek 3. Struktura cząsteczki PK2 z targetującym ligandem R: galaktozamina.
Bibilografia:
1. Allen TM (2002). Ligand-targeted therapeutics in anticancer therapy. Nature Rev Drug Discov 2:750–763.
2. Harris JM, Chess RB (2003). Effect of pegylation on pharmaceuticals. Nature Rev Drug Discov 2:214–221.
3. Orive G, Anitua E (2009). Biomaterials for promoting brain protection, repair and regeneration. Nat Rev Neurosci 10(9):682-92.
4. Honey PJ (2014). Smart polymers for the controlled delivery of drugs - a concise overview. Acta Pharm Sin B 4(2): 120-127.
5. Allemann E, Gurny R (1993). Drug-Loaded Nanoparticles: Preparation Methods and Drug Targeting Issues. Eur J Pharm Biopharm 39(5) 173-191.
6. Kasagana VN, Karumuri SS (2011). Recent Advances in Smart Drug Delivery Systems. International Journal of Pharmacy and Biotechnology 1(3) 201-207.
7. Fresta M, Cavallaro G (1996). Preparation and Characterization of Polyethyl-2-Cyanoacrylate Nanocapsules containing Antiepileptic Drugs. Biomaterials 17(8) 751-758.
8. Hans ML. Lowman AM (2002). Biodegradable Nanoparticles for Drug Delivery and Targeting. Current Opinion in Solid State and Materials Science 6(4) 319-327.
9. Allemann E, Doelker E (1993). Drug Loaded Poly(lactic acid) Nanoparticles Produced by a Reversible Salting-out Process: Purification of an Injectable Dosage Form. Eur J Pharm Biopharm 39 13-18.
10. Fessi H, Puisieux F (1989). Nanocapsule Formation by Interfacial Polymer Deposition Following Solvent Displacement. International. Int. J. Pharm. 55(1) R1-R4.
11. Chen X, Young TJ (2002) Preparation of Cyclosporine a Nanoparticle by Evaporative Precipitation into Aqueous Solution. Int. J. Pharm 242(1-2) 3-14.
12. Gomez A, Bingham D (1998). Production of Protein Nanoparticles by Electrospray Drying. Journal of Aerosol Science 29(5-6) 561-574.
13. Santini JT, Richards AC (2000). Microchips as Controlled Drug-Delivery Devices. Angew Chem Int Ed 39:2396-407.
14. Kopecek J (2003). Smart and genetically engineered biomaterials and drug delivery systems. Eur J Pharm Sci 20:1-16.
15. Vicent MJ, Duncan R (2006). Polymer conjugates: nanosized medicines for treating cancer. Trends Biotechnol 24:39–47.
16. Haag R, Kratz F (2006). Polymer therapeutics: concepts and applications. Angew Chem Int Ed Engl 3;45(8):1198-215.
17. Lammers T (2010). Improving the efficacy of combined modality anticancer therapy using HPMA copolymer-based nanomedicine formulations. Adv Drug Deliv Rev 62:203–230.
10. Fessi H, Puisieux F (1989). Nanocapsule Formation by Interfacial Polymer Deposition Following Solvent Displacement. International. Int. J. Pharm. 55(1) R1-R4.
11. Chen X, Young TJ (2002) Preparation of Cyclosporine a Nanoparticle by Evaporative Precipitation into Aqueous Solution. Int. J. Pharm 242(1-2) 3-14.
12. Gomez A, Bingham D (1998). Production of Protein Nanoparticles by Electrospray Drying. Journal of Aerosol Science 29(5-6) 561-574.
13. Santini JT, Richards AC (2000). Microchips as Controlled Drug-Delivery Devices. Angew Chem Int Ed 39:2396-407.
14. Kopecek J (2003). Smart and genetically engineered biomaterials and drug delivery systems. Eur J Pharm Sci 20:1-16.
15. Vicent MJ, Duncan R (2006). Polymer conjugates: nanosized medicines for treating cancer. Trends Biotechnol 24:39–47.
16. Haag R, Kratz F (2006). Polymer therapeutics: concepts and applications. Angew Chem Int Ed Engl 3;45(8):1198-215.
17. Lammers T (2010). Improving the efficacy of combined modality anticancer therapy using HPMA copolymer-based nanomedicine formulations. Adv Drug Deliv Rev 62:203–230.





