Wojciech Kamysz
Laboratorium Badawczo-Rozwojowe Lipopharm.pl
strony wersji drukowanej: 38-40
strony wersji drukowanej: 38-40

Peptydy i białka należą do biopolimerów z którymi w obecnych czasach wiąże się duże nadzieje aplikacyjne. Fascynacja ta trwa jednak już po-nad pięćdziesiąt lat. W roku 1954 została opisana przez Vigneaud’a synteza oksytocyny. Wraz z tym wydarzeniem powstały teorie, że peptydy mogą zastąpić konwencjonalne leki. Obecnie roczna produkcja leków peptydowych (z wyłączeniem insuliny) sięga około jednej tony. Insulina produkowana jest w ilości około 20 ton rocznie, przez dwóch światowych gigantów Novo Nordisc (Dania) oraz Eli Lilly (USA). Wynika z tego, że rynek leków peptydowych poza insuliną jest bardzo ubogi. Dzieje się to głównie za sprawą problemów z jakimi borykają się producenci. Najważniejszym jest wysoki koszt otrzymywania peptydów. Do tego dochodzą poważne problemy ze stworzeniem postaci leku (niska biodostępność, niska trwałość chemiczna i biologiczna), ale i typowe problemy z przechowywaniem leków peptydowych. Odizolowanie produktu (substancji leczniczej lub postaci leku) od niesprzyjających warunków poprzez np. właściwe opakowanie, powlekanie postaci leku (całej lub fragmentów), stosowanie postaci mikrokompartmentowych (liposomy, mikro- i nanokapsułki), stosowanie cyklodekstryn, zmiana stopnia rozdrobnienia nie zawsze pomaga. Czasami najskuteczniejsze okazuje się stosowanie substancji pomocniczych gwarantujących trwałość, stosowanie inhibitorów enzymów (np. inhibitorów proteaz), przeciwutleniaczy (kwas askorbinowy, askorbinian sodu, glutation, tiosiarczan sodu), czy modyfikacja struktury związków chemicznych (zastosowanie aminokwasów w konfiguracji D zamiast L).
Synteza na nośniku stałym
Synteza na nośniku stałym ma niespełna 50 lat. Powszechnie znane podejście, nazywane od nazwiska twórcy metodą Merrifielda, posiada wiele zalet, dzięki którym peptydy w obecnych czasach syntezuje się stosunkowo szybko, często z wykorzystaniem urządzeń, zwanych syntezatorami peptydów. Pierwsze tego typu urządzenia powstały już w latach 60-tych. Technika syntezy z wykorzystaniem nośników polega na przyłączeniu do nierozpuszczalnego w fazie organicznej polimeru substratu, do którego dobudowuje się kolejne segmenty, aminokwasy. Sam nośnik wcześniej jednak specjalnie przygotowuje się celem uzyskania odpowiedniego linkera, do którego przyłącza się pierwszy z aminokwasów. Linker jest ugrupowaniem chemicznym łączącym nierozpuszczalny polimer z pierwszym przyłączanym aminokwasem. Gwarantuje trwałość połączenia w trakcie syntezy oraz łatwe odszczepianie zbudowanego peptydu podczas deprotekcji gotowego produktu. Synteza na nośniku stałym ma olbrzymie zalety, dzięki którym w ostatnich latach gwałtownie rozwinęła się synteza organiczna różnorakich molekuł, począwszy od biopolimerów takich jak kwasy nukleinowe, oligo- i polisacharydy, kończąc na związkach niskocząsteczkowych. Nadmiar nieprzereagowanych substratów z łatwością odmywa się w specjalistycznych naczyniach, zwanych powszechnie naczyniami Merrifielda. Podejście to pozwala na stosowanie dużych nadmiarów reagentów, minimalizację skali syntezy oraz stosowanie często substratów toksycznych. Wspominana wcześniej możliwość automatyzacji syntezy na nośniku w ostatnim pięcioleciu została wzbogacona w możliwość syntezy w pełni automatycznych syntezatorach mikrofalowych, dzięki czemu procesy kondensacji amino-kwasów można przyspieszyć nawet 10 krotnie.
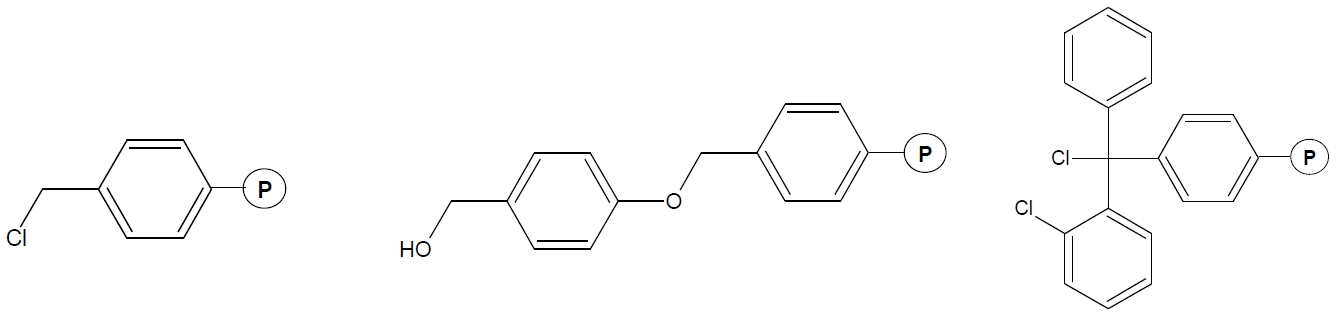
Rys. 1. Przykłady nośników (żywic) do syntezy peptydów. A – Merrifielda, B – Wanga, C – 2-chlorotritylowa
Chemia Boc, Fmoc i nic więcej…
Chemiczna synteza peptydów opiera się na zastosowanie grup ochronnych. Kluczową sprawą w projektowaniu syntezy jest wykorzystanie ortogonalności stosowanych osłon łańcuchów bocznych stosowanych aminokwasów oraz osłony grupy α-aminowej każdorazowo przyłączanego substratu. Już od czasów pionierskich odkryć dotyczących syntez na nośniku do osłony grup aminowych stosuje się osłonę tert-butyloksykarbonylową (Boc). Ugrupowanie to odszczepiane zwykle z wykorzystaniem kwasu trifluorooctowego nie należy do osłon chętnie wykorzystywanych w syntezie krok po kroku. Dodatkowo strategia Boc wymaga do odszczepianie peptydów od nośnika ciekłego fluorowodoru. Równolegle w latach 70-tych do syntezy wprowadzono osłonę Fmoc (9-fluorenylometoksy-karbonylową), która ulega odszczepieniu z użyciem piperydyny. Ze względu na koszt pochodnych aminokwasowych, powszechna stała się ona w laboratoriach dopiero 20 lat później. W obu podejściach syntetycznych stosuje się identyczne środki kondensujące i przeciwracemizacyjne (od 50 lat te same!). Pomimo, że powstają nowe nośniki a katalogi dedykowane laboratoriom peptydowym są pełne „nowości” w gruncie rzeczy opierają się na tych samych linkerach. Ze względów marketingowych nośnikom przypisuje się nadzwyczajne właściwości. W rzeczywistości są to zwykle polimery bazujące na polistyrenie sieciowanym diwinylobenzenem w ilości 0,5-2%. Szacuje się, że żywice oparte o polistyren stanowią 90% wszystkich nośników stosowanych w syntezie organicznej. W praktyce wybór żywicy zastosowanej do syntezy peptydu zależy od struktury syntezowanego peptydu (np. od tego czy syntezowany peptyd ma po-siadać wolna grupę karboksylową na C-końcowym aminokwasie, czy też grupę amidową) oraz czy peptydy posiadają krótki, czy długi łańcuch. W przypadku peptydów dłuższych stosuje się nośniki o mniejszym osadzeniu grup funkcyjnych.
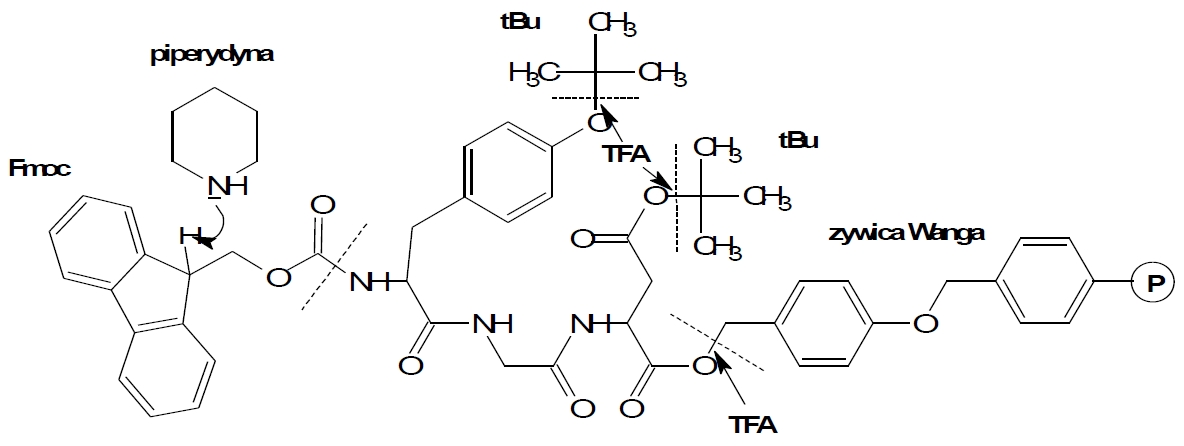
Rys. 2. Schemat reakcji podczas syntezy metodą Fmoc.
Oczyszczanie i analiza
Oczyszczanie peptydów należy do czynności o dużej trudności. Pozostające w próbce zanieczyszczenia często bowiem są też peptydami o podobnej strukturze. Proces oczyszczania komplikuje często fakt możliwości zmian chemicznych w trakcie przygotowania próbki lub samego rozdziału. Przykładami jest utlenianie wolnych reszt cysteiny do wiązań disulfidowych, cyklizacja N-końcowej glutaminy do kwasu piroglutaminowego czy modyfikacja reszt aminokwasów po-przez przyłączanie się aktywnych pochodnych osłon podczas deprotekcji z nośnika. Pierwszymi sposobami oczyszczania peptydów była klasyczna chromatografia kolumnowa na krzemionce. Szybko jednak została wyparta przez filtrację żelową na złożach Sephadex oraz chromatografię jonowymienną. Do lat 80-tych techniki te były jedynymi sprawnymi sposobami oczyszczania syntetycznych peptydów. Wraz z wprowadzeniem do chemii wysokosprawnej chromatografii cieczowej (HPLC), metody te często mają znaczenie historyczne i młode pokolenie badaczy zajmujących się peptydami nawet ich nie umie. HPLC w układzie faz odwróconych wymaga jednak drogiego sprzętu co powoduje, że w obecnych czasach nie wszystkie zespoły naukowe są zdolne do samodzielnej syntezy i oczyszczania peptydów. Najprostszy chromatograf preparatywny wraz z kolumną kosztuje około 100 tyś PLN. Do tego dochodzi koszt eluentów i materiałów oraz kosztów serwisowania sprzętu, który jest podatny na awarie. Otrzymanie suchej próbki jest realizowane poprzez suszenie sublimacyjne z użyciem liofilizatorów. Kolejnym ograniczeniem jest badanie tożsamości otrzymanych produktów. Zarówno wykonanie analizy aminokwasowej (obecnie odchodzi się od tego) jak i uzyskanie widma masowego wymaga posiadania specjalistycznego sprzętu lub zlecenia drogich analiz specjalistycznym pracowniom. Zdarza się, że po syntezie otrzymuje się kilka produktów i te koszty są jeszcze wyższe. W chwili obecnej największe korzyści przynosi spektrometria mas z jonizacją techniką desorpcji laserowej na matrycy i analizatorem czasu przelotu (MALDI-TOF). Najnowocześniejsze spektrometry mas posiadają też możliwość określenia sekwencji aminokwasowej oraz przypisania struktury zanieczyszczeniom.
Chemia kombinatoryczna i niespełnione nadzieje
Możliwość łączenia aminokwasów w różne kombinacje w połączeniu z metodą syntezy na nośniku polimerowym zaowocowała rozwojem chemii równoległej i chemii kombinatorycznej. Do kluczowych podejść należy procedura opracowana w 1984 r. przez Geysena (osadzanie aminokwasów na prętach polietylenowych, które zanurzane są w naczyniach reakcyjnych z odpowiednim aminokwasem), czy rok później opublikowana metoda torebek herbacianych Houghtena (żywica umieszczona w perforowanych torebkach polipropylenowych). Kamieniem milowym mogła okazać się upubliczniona w 1988 r. metoda portioning–mixing Arpada Furki, polegająca na rezygnacji z kontroli sekwencji syntezowanych peptydów i wymagająca wyłącznie sekwencyjnego dzielenia i mieszania nośników wraz z peptydami. Patrząc na liczbę doniesień naukowych związanych z chemią kombinatoryczną faktyczne efekty nie są jednak imponujące.





